La relación de la química con la bioseguridad
Masas Molares
La masa molar de los átomos de un elemento está dado por el peso atómico de cada elemento, es la cantidad de masa que una sustancia contiene en un mol.
Un mol equivale a 6.022 * 10 elevado a 23 moléculas.
Un elemento equivale a 6.022 * 1o elevado a las 23 átomos.
Un mol equivale a 22,4 l.
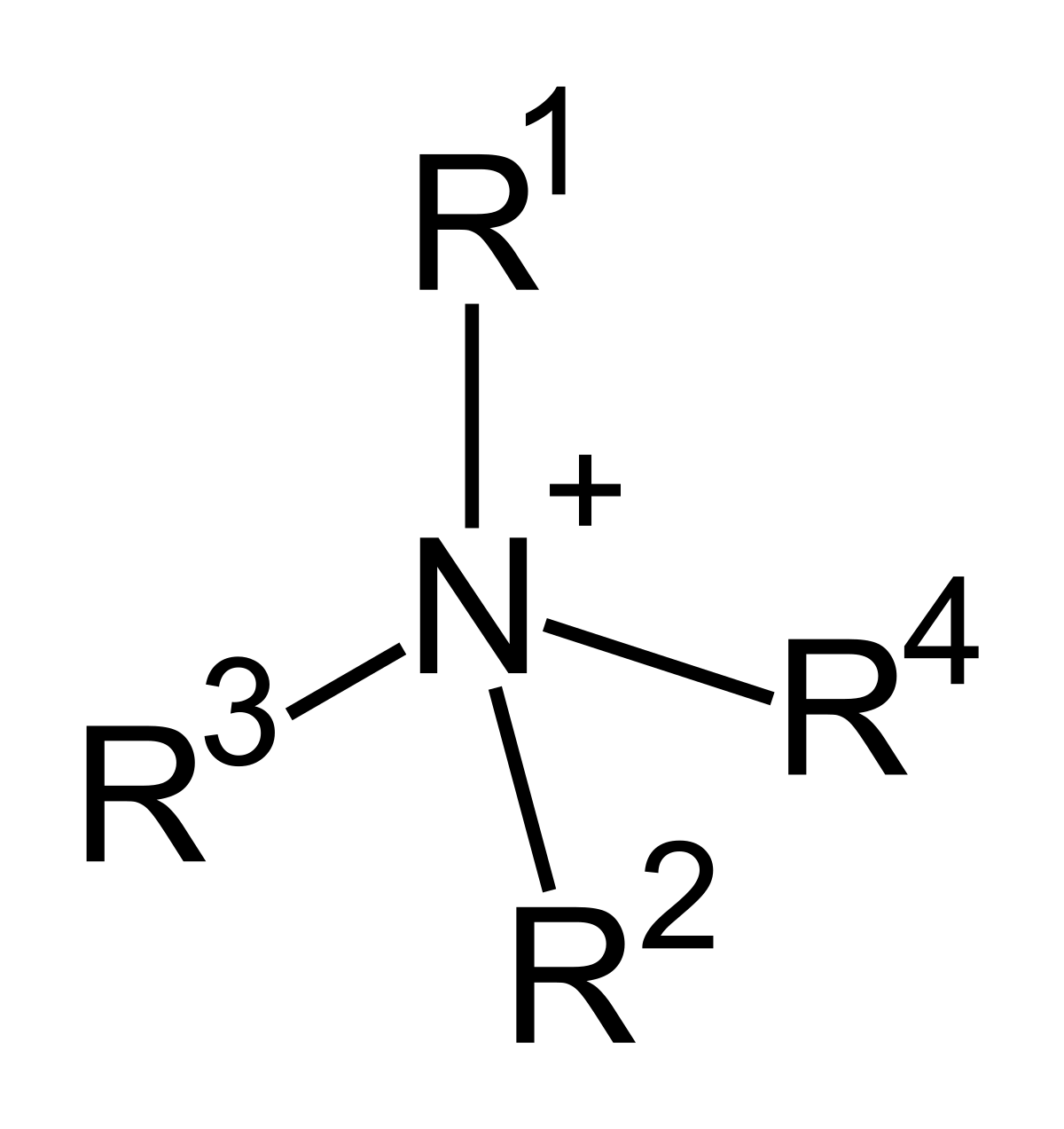
Amonio Cuaternario
Los amonios cuaternarios son compuestos químicos
clasificados dentro del grupo de los tensioactivos catiónicos. Su estructura
general comprende una porción catiónica compuesta por un átomo de nitrógeno
unido a cuatro cadenas alquílicas (parte funcional de la molécula) y un átomo
halógeno (generalmente cloro).
Su naturaleza neutra y su relativa inocuidad hacen de los amonios cuaternarios un compuesto ideal para la desinfección de superficies y ambientes, entre sus principales ventajas podemos encontrar:
- Amplio espectro bactericida fungicida y virucida: Su mecanismo de actuación, penetrando y rompiendo la membrana citoplasmática, degradando proteínas y ácidos nucleicos y, finalmente, provocando la lisis celular, le confiere excelentes propiedades frente a todo tipo de microorganismos.
- Baja corrosividad:No atacan la mayoría de superficies presentes a nivel industrial e institucional y su manipulación es relativamente segura comparada con la de otros principios desinfectantes, siempre usando las medidas de protección pertinentes.
- Efectividad: Incluso en presencia de materia orgánica, especialmente en el caso de las últimas generaciones de amonios cuaternarios
- Poder residual. Sus características físico-químicas hacen que, en caso de no ser aclarados, se mantengan sobre las superficies y conserven durante tiempo su eficacia desinfectante.
La fórmula química del amoníaco es NH3 (nitrógeno, hidrógeno
3) y cuando se mezcla con agua forma el hidróxido de amonio, que es un
compuesto, cuyo uno de sus componentes es el amonio cuaternario.
Formulación química
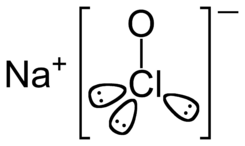
Hipoclorito de sodio
El hipoclorito de sodio está formado por un átomo de sodio
(Na), uno de cloro (Cl) y uno de oxígeno (O). Por lo tanto, su fórmula química
es NaClO. El poder desinfectante de este compuesto reside en su poca
estabilidad en solución acuosa y en su alto poder oxidante.
Contiene cloro en estado de oxidación +1, es un oxidante
fuerte y económico. Debido a esta característica se utiliza como desinfectante;
además destruye muchos colorantes por lo que se utiliza como blanqueador.
El hipoclorito reacciona a temperaturas elevadas para dar clorato y cloruro:
3 NaClO → 2 NaCl + NaClO3
A veces se aprovecha esta reacción para la síntesis del clorato. Con aminas se forman las cloraminas. Estos compuestos suelen ser tóxicos y pueden ser explosivos. No es inflamable, pero reacciona en presencia de fuego.
El hipoclorito de sodio al reaccionar con el agua origina ácido hipocloroso, este a su vez se desintegra en ácido clorhídrico y oxígeno:
Cuando es disuelto en agua este se descompone lentamente, originando sodio, cloruros y radicales hidroxilos:
NaClO + H2O → Na+ + Cl− + 2 HO•
Estos radicales hidroxilo pueden oxidar compuestos orgánicos
o reaccionar para formar agua y oxígeno
R-CH2-OH +
4 HO• → R-COOH + 3 H2O
4 HO• → 2 H2O + O2 (disuelto o gaseoso)
Pasándolo a través de una solución acuosa enfriada de hipoclorito de sodio y dióxido de carbono, se puede obtener una solución de ácido hipocloroso:
NaClO + H2O + CO2 → NaHCO3↓ + HClO
Formulación química
Calvente, D. (1 de Abril de 2020). Evolución y características de los amonios cuaternarios para desinfección de superficies. Obtenido de https://www.proquimia.com/evolucion-y-caracteristicas-de-los-amonios-cuaternarios-para-desinfeccion-de-superficies/
Rosa, D. G. (14 de Enero de 2018). El hipoclorito y el cloro: dos tipos de cuidado. Obtenido de https://www.ugto.mx/eugreka/contribuciones/262-el-hipoclorito-y-el-cloro-dos-tipos-de-cuidado





No hay comentarios.:
Publicar un comentario